Exploiter un spectre IR pour déterminer des groupes caractéristiques à l'aide de tables de données ou de logiciels. Dosage par étalonnage : Pratiquer une démarche.
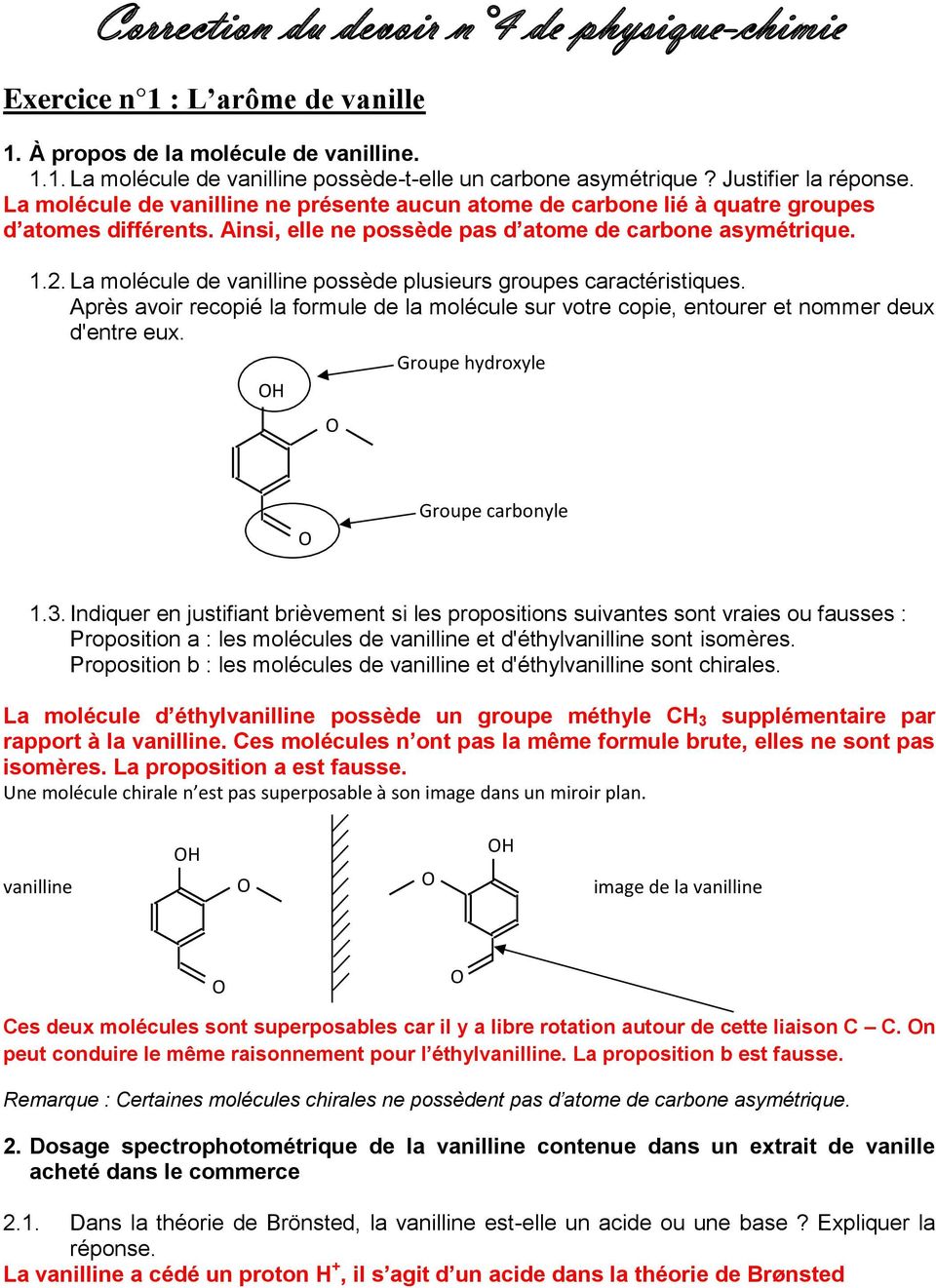
L’objectif de cet exercice est d’étudier la vanilline et de contrôler sa teneur dans un extrait de vanille. Données. p K A du couple vanilline / ion vanillinate, noté AH / A –, à 25 °C : p K.
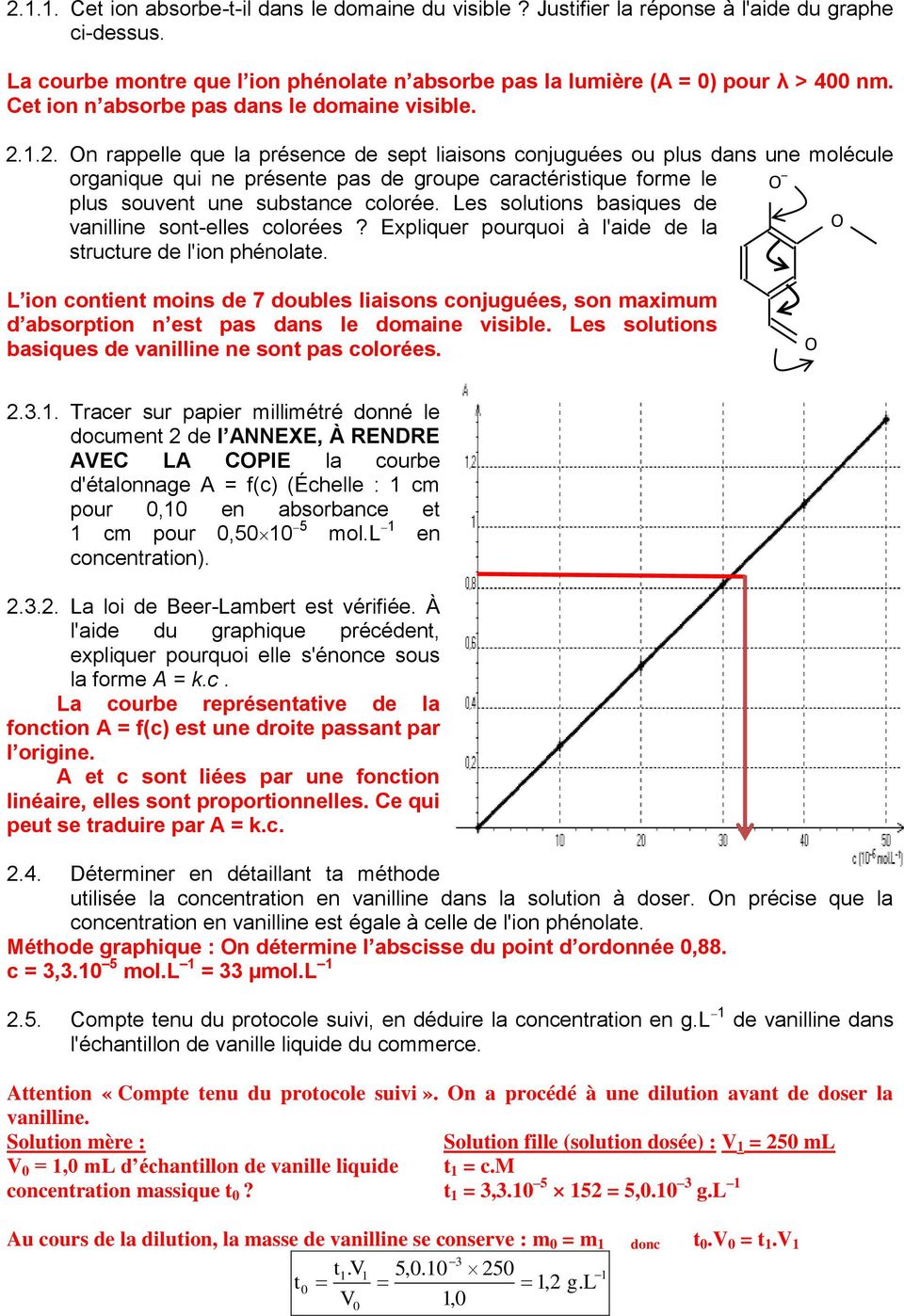
Exercice 1. Dosage spectrophotométrique de la vanilline (6 points) 1.1.1. (1 pt) La courbe montre que l’ion phénolate n’absorbe pas la lumière dans le domaine visible (A = 0.
Un gramme de gousse de vanille peut contenir de 5 à 25 mg de vanilline (énoncé). Les « 4 % en masse de gousse de vanille » indiqués sur le sachet correspondent donc à une.
V1 = 10,0 mL de cette solution est placé dans un bécher de 100 mL. La solution violette de permanganate de potassium de concentration C2 = 1,00×10-2 mol.L-1 est ensuite versée.
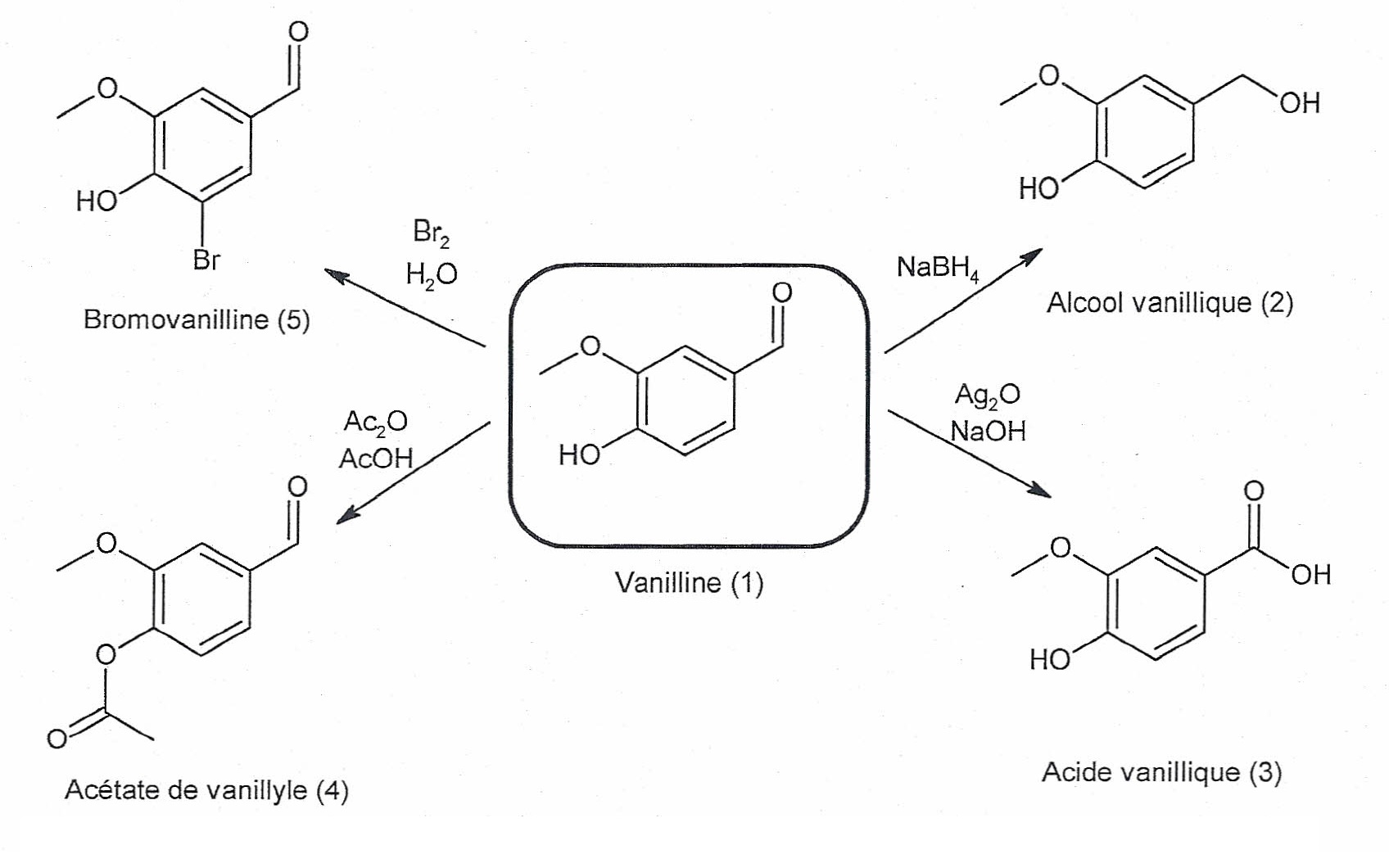
La note dominante de l'arôme de la vanille naturelle est donnée par la molécule de vanilline ou 4-hydroxy-3-méthoxybenzaldéhyde, de formule brute C9H902 . Dans cet exercice, on.
1) Donner les caractéristiques d’une équation de dosage. 2) Calculer n V, la quantité d’hydroxyde de sodium versée à l’équivalence. 3) En déduire la masse d’ibuprofène.
Chapitre 4 : Dosage par étalonnage Activité 1 : Vanille et Vanilline ... Corrige 2018 concours Geipi Polytech Physique-chimie - Jcours. EXERCICE I. L'arome de vanille (5 points) 1/4.
On procède à trois extractions successives en utilisant à chaque fois 20 mL de dichlorométhane. À partir de la phase organique, on extrait trois fois la vanilline avec 50.
Voici le mode opératoire de la synthèse de l'acétate d'isoeugénol qui constitue la première étape de la synthèse de la vanilline : introduire m1. . = 10,0 g d'isoeugénol, V 2. . = 20,0.
Le but de l'exercice est d'effectuer le dosage d'un vinaigre. Pour cela on dosera l'acide éthanoïque du vinaigre par une solution d'hydroxyde de sodium ( soude) de.